Biologia:
Biomoléculas Inorgânicas:
ÁGUA
S.jpg) em água, não há vida. Em média, ela constitui 70% da massa corpórea dos seres vivos, ainda que alguns tenham mais (96% nas medusas) e outros tenham menos (20% nas sementes. A água é utilizada como meio para as reações químicas (nela estão dissolvidas muitas substâncias), transporta substâncias, dá forma às células, amortece articulações e regula a temperatura do corpo. (Veja: Tudo Sobre a Água)
em água, não há vida. Em média, ela constitui 70% da massa corpórea dos seres vivos, ainda que alguns tenham mais (96% nas medusas) e outros tenham menos (20% nas sementes. A água é utilizada como meio para as reações químicas (nela estão dissolvidas muitas substâncias), transporta substâncias, dá forma às células, amortece articulações e regula a temperatura do corpo. (Veja: Tudo Sobre a Água)
.jpg) em água, não há vida. Em média, ela constitui 70% da massa corpórea dos seres vivos, ainda que alguns tenham mais (96% nas medusas) e outros tenham menos (20% nas sementes. A água é utilizada como meio para as reações químicas (nela estão dissolvidas muitas substâncias), transporta substâncias, dá forma às células, amortece articulações e regula a temperatura do corpo. (Veja: Tudo Sobre a Água)
em água, não há vida. Em média, ela constitui 70% da massa corpórea dos seres vivos, ainda que alguns tenham mais (96% nas medusas) e outros tenham menos (20% nas sementes. A água é utilizada como meio para as reações químicas (nela estão dissolvidas muitas substâncias), transporta substâncias, dá forma às células, amortece articulações e regula a temperatura do corpo. (Veja: Tudo Sobre a Água)SAIS MINERAIS
 Formam as partes duras dos seres vivos: as conchas dos moluscos (carbonato de cálcio) e os esqueletos dos vertebrados (fosfato de cálcio). Outros intervém em reações químicas, mantêm a salinidade do organismo (cloreto de sódio e potássio), interferem na transmissão do impulso nervoso ou formam parte de moléculas importantes, como a hemoglobina do sangue. (Veja: Sais Minerais)
Formam as partes duras dos seres vivos: as conchas dos moluscos (carbonato de cálcio) e os esqueletos dos vertebrados (fosfato de cálcio). Outros intervém em reações químicas, mantêm a salinidade do organismo (cloreto de sódio e potássio), interferem na transmissão do impulso nervoso ou formam parte de moléculas importantes, como a hemoglobina do sangue. (Veja: Sais Minerais)Biomoléculas Orgânicas:
 GLICÍDIOS
GLICÍDIOS
São biomoléculas compostas de carbono, hidrogênio e oxigênio, com função energética, como "combustíveis" para os seres vivos, e estrutural, formando partes dos seres vivos. Os mais conhecidos são a glicose (açúcar do mel) e a sacarose (açúcar da cana), que são energéticos; o amido, que serve como reserva de energia nas plantas; e a celulose, que forma as paredes das células vegetais. (Veja: Glicídios)
.jpg) LIPÍDIOS
LIPÍDIOS
São formados por carbono, hidrogênio, oxigênio e outros elementos, como o fósforo. Sua função é energética e estrutural. São muito diversificados e desempenham várias funções no organismo. As gorduras servem como reserva de energia. Os fosfolipídios e o colesterol formam partes das membranas celulares. Algumas vitaminas, como A e D, são lipídios. (Veja: Lipídios)
 PROTEÍNAS
PROTEÍNAS
Formadas por carbono, hidrogênio, oxigênio, nitrogênio e outros elementos, são polímeros de biomoléculas menores, os aminoácidos. Suas funções são muito variadas: o colágeno da pele tem função estrutural, a hemoglobina do sangue transporta oxigênio, os anticorpos intervém na defesa contra infecções e as enzimas regulam as reações químicas nas células. (Veja: Proteínas)
 ÁCIDOS NUCLEICOS
ÁCIDOS NUCLEICOS
Formados por carbono, hidrogênio, oxigênio, nitrogênio e fósforo, são biomoléculas constituídas por longas cadeias de moléculas menores, chamadas nucleotídios. Há dois tipos de ácidos nucleicos: o ácido desoxirribonucleico (DNA) e o ácido ribonucleico (RNA). O DNA contém a informação genética que tem codificadas várias das características de um ser vivo.
ATIVIDADES:
Exercício 1:
Com relação às características gerais dos seres vivos, é incorreto afirmar:
A) Células procarióticas e eucarióticas apresentam membrana plasmática.
B) Apenas as células eucarióticas apresentam ribossomos.
C) A reprodução sexuada é fundamental para a variabilidade genética da espécie.
D) O processo de degradação de substâncias complexas em substâncias simples é conhecido como catabolismo.
E) As adaptações sofridas pelos organismos, ao longo de suas vidas, podem levar a um processo de evolução.
Exercício 2:
Um extraterrestre que resolvesse estudar a composição química das formas de vida em nosso planeta poderia concluir, de maneira correta, que ela é baseada em compostos de carbono, água e sais minerais. Assinale a(s) proposição(ões) correta(s).
1) Nos seres vivos as substâncias mais abundantes são: água (70% a 85%), lipídios (10% a 15%), glicídios (7% a 10%) e proteínas (2% a 3%).
2) Os íons cálcio desempenham importante função nos processos da contração muscular e da coagulação do sangue.
4) Os compostos proteicos miosina e hemoglobina têm como principal elemento na sua composição os íons magnésio.
8) Os glicídios desempenham papel importante na estrutura dos ácidos nucleicos, os quais são importantes na transmissão das características dos seres vivos.
16) Os fosfolipídios, uma classe especial de lipídios, são essenciais na formação das membranas celulares.
32) Todos os aminoácidos, essenciais e não essenciais, utilizados por nossas células na formação das proteínas, são necessariamente obtidos através da alimentação.
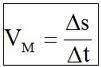
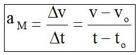
Física:
Cinemática:
Cinemática é a parte da Mecânica que descreve o movimento, determinando a posição, a velocidade e a aceleração de um corpo em cada instante.
Os corpos em estudo, denominado móveis, são considerados pontos materiais. Ponto material é um corpo cujas dimensões não interferem no estudo de determinado fenômeno.
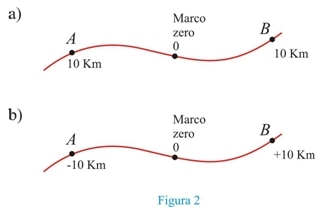
Na trajetória escolhemos arbitrariamente um marco zero, a partir do qual medimos comprimentos que indicam a posição do móvel, mas não fornecem nem o sentido nem a distância percorrida.
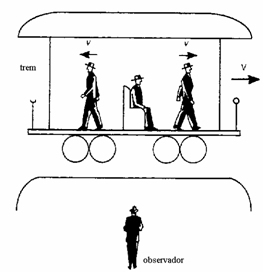
Um corpo está em movimento quando sua posição muda no decorrer do tempo. Deste modo, a noção de movimento e de repouso de um móvel é sempre relativa a outro corpo. O corpo em relação ao qual identificamos se um móvel está em movimento ou em repouso é chamado referencial ou sistema de referência. Veja a figura abaixo:
Tempo é uma noção aceita sem definição, fundamental na descrição de qualquer movimento.
Posição numa trajetória
Trajetória é o conjunto de posições sucessivas ocupadas por um móvel no decorrer do tempo. Veja abaixo:

Entretanto um móvel pode estar de um laço ou de outro relativamente ao marco zero (fig. 2a), sendo então conveniente orientar a trajetória, adotando-se um sentido positivo(fig. 2b).Assim a posição do móvel A fica definida pela medida algébrica -10 Km e a de B por +10Km.

A medida algébrica do arco da trajetória que vai do marco zero à posição do móvel recebe o nome de espaço, indicado pela letra s. O marco zero 0 é então a origem dos espaços. Na figura 2b o espaço do móvel A, independentemente do sentido do seu movimento é SA = -10Km e o de B, SB = +10Km
Referencial

O trem encontra-se em movimento em relação ao observador;
O Homem sentado encontra-se em repouso em relação ao trem.
O Homem sentado encontra-se em repouso em relação ao trem.
Um ponto material está em movimento em relação a um determinado referencial quando sua posição, nesse referencial, varia no decurso do tempo.
Um ponto material está em repouso em relação a um determinado referencial quando sua posição, nesse referencial, não varia com o decurso do tempo.
Deslocamento Escalar
É a diferença algébrica entre os espaços relativos às posições final (aonde se chega) e inicial (de onde se sai), medidas em metro, como recomenda o S.I.
Portanto: Ds = s - so
Ds = Deslocamento escalar
s = Espaço final
so = Espaço inicial
s = Espaço final
so = Espaço inicial
Obs: O sinal positivo ou o negativo que se pode obter para o deslocamento escalar nos dirá se ele foi efetuado a favor ou contra o sentido arbitrado para a trajetória.
Velocidade Escalar Média
O conhecimento do deslocamento escalar entre dois instantes, embora dê uma ideia geral de como evolui a posição do corpo sobre a trajetória, pode ser complementado com uma grandeza que indica a rapidez com que tal evolução ocorre.
Para tanto, define-se a grandeza denominada velocidade escalar média, representada simbolicamente por Vm, equação:
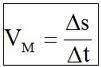
Vm = velocidade média
ΔS = variação do espaço
Δt = variação do tempo
ΔS = variação do espaço
Δt = variação do tempo
Velocidade Escalar Instantânea
Ao se tentar descrever um movimento em um certo intervalo de tempo, através da velocidade média, obtém-se apenas uma informação global a respeito do problema, podendo-se distorcer a interpretação da situação física.
Por exemplo, a velocidade escalar média de um corpo num certo intervalo de tempo pode ser nula, mesmo tendo havido movimento do corpo no referido intervalo.
Assim, para melhor descrever a rapidez de um movimento, instante por instante, define-se velocidade escalar instantânea como a velocidade escalar média em um intervalo de tempo infinitamente curto.
Aceleração Escalar Média
É muito comum, em situações práticas de interesse, ocorrerem movimentos em que a velocidade escalar instantânea é variável.
— Um automóvel acelerando a partir do repouso.
— Um automóvel freando diante de um obstáculo.
Nessas situações, é necessário medir a rapidez de variação da velocidade escalar e utiliza-se, para isso, o conceito de aceleração escalar média, representada simbolicamente por am, definido como se segue.
— Um automóvel freando diante de um obstáculo.
Nessas situações, é necessário medir a rapidez de variação da velocidade escalar e utiliza-se, para isso, o conceito de aceleração escalar média, representada simbolicamente por am, definido como se segue.
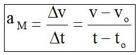
Aceleração Escalar Instantânea:
Assim como a velocidade escalar média, a aceleração escalar média também oferece apenas uma informação global a respeito da variação da velocidade num dado intervalo de tempo, podendo distorcer a interpretação da situação física.
Por exemplo, a aceleração escalar média de um corpo em um certo intervalo de tempo pode ser nula, mesmo tendo havido mudança no valor da velocidade escalar instantânea do corpo no referido intervalo.
Assim, para melhor descrever a rapidez da variação da velocidade escalar de um corpo, define-se aceleração escalar instantânea como a aceleração escalar média em um intervalo de tempo infinitamente curto.

Água nas três fases, representando o ponto tríplice




Destilação Simples
Pelo menos uma das fases não é sólida
ATIVIDADES:
01. Um macaco que pula de galho em galho em um zoológico, demora 6 segundos para atravessar sua jaula, que mede 12 metros. Qual a velocidade média dele?
02. Durante uma corrida de 100 metros rasos, um competidor se desloca com velocidade média de 5m/s. Quanto tempo ele demora para completar o percurso?
03. Durante uma corrida de carros, um dos competidores consegue atingir 100km/h desde a largada em 5s. Qual a aceleração média por ele descrita?
04. Um móvel, partindo do repouso com uma aceleração constante igual 1m/s² se desloca durante 5 minutos. Ao final deste tempo, qual é a velocidade por ele adquirida?
Química:
Diagrama de Fases:
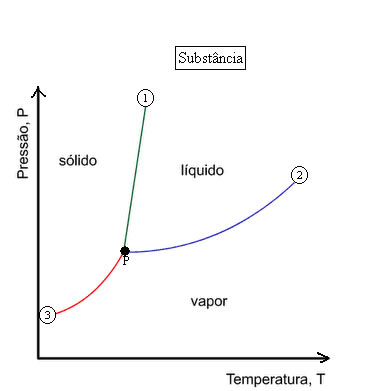
O gráfico que representa as fases da matéria termodinamicamente em função da pressão e da temperatura é chamado de diagrama de fases.

A curva 1, que delimita as regiões das fases sólida e líquida, representa a curva de fusão, onde os estados sólido e líquido da substância estão em equilíbrio.
A curva 2, que delimita as regiões das fases líquido e vapor, representa a curva de vaporização, onde os estados líquido e vapor estão em equilíbrio.
A curva 3, que delimita as regiões das fases sólida e vapor, representa a curva de sublimação, onde os estados sólido e vapor estão em equilíbrio.
O ponto P é um ponto comum às três curvas e é denominado ponto triplo ou ponto tríplice, neste ponto as três fases – sólido, líquido e gasoso, estão em equilíbrio.
O ponto triplo da água ocorre quando a mesma está à temperatura 0,01°C sob pressão de 611,73 pascal.
A curva 2, que delimita as regiões das fases líquido e vapor, representa a curva de vaporização, onde os estados líquido e vapor estão em equilíbrio.
A curva 3, que delimita as regiões das fases sólida e vapor, representa a curva de sublimação, onde os estados sólido e vapor estão em equilíbrio.
O ponto P é um ponto comum às três curvas e é denominado ponto triplo ou ponto tríplice, neste ponto as três fases – sólido, líquido e gasoso, estão em equilíbrio.
O ponto triplo da água ocorre quando a mesma está à temperatura 0,01°C sob pressão de 611,73 pascal.

Água nas três fases, representando o ponto tríplice
Curva de Fusão
A curva de fusão é avaliada sob dois aspectos: para substâncias que se dilatam na fusão (grande parte das substâncias) e para substâncias que se contraem na fusão (água, bismuto, ferro e antimônio).
Grande parte das substâncias: o aumento da pressão é seguido do aumento da temperatura de fusão.
Água – Bismuto – Ferro – Antimônio: o aumento da pressão é seguido de diminuição da temperatura de fusão.
Curva de Vaporização
A vaporização pode ocorrer de duas formas: por ebulição ou por evaporação. A temperatura de vaporização por ebulição depende da pressão de tal forma que à medida que aumentamos a pressão, a temperatura de ebulição também aumenta.
A vaporização por evaporação é um processo que pode ocorrer sob pressão atmosférica, independente da temperatura (moléculas de um líquido, por exemplo, não possuem a mesma velocidade; algumas mais velozes conseguem escapar da superfície do líquido, fazendo com que o mesmo evapore).
Curva de Sublimação
Sólido ou vapor que se encontra abaixo da pressão do ponto triplo, se aquecido ou resfriado respectivamente, passa diretamente de uma fase para outra.
A curva de fusão é avaliada sob dois aspectos: para substâncias que se dilatam na fusão (grande parte das substâncias) e para substâncias que se contraem na fusão (água, bismuto, ferro e antimônio).
Grande parte das substâncias: o aumento da pressão é seguido do aumento da temperatura de fusão.
Água – Bismuto – Ferro – Antimônio: o aumento da pressão é seguido de diminuição da temperatura de fusão.
Curva de Vaporização
A vaporização pode ocorrer de duas formas: por ebulição ou por evaporação. A temperatura de vaporização por ebulição depende da pressão de tal forma que à medida que aumentamos a pressão, a temperatura de ebulição também aumenta.
A vaporização por evaporação é um processo que pode ocorrer sob pressão atmosférica, independente da temperatura (moléculas de um líquido, por exemplo, não possuem a mesma velocidade; algumas mais velozes conseguem escapar da superfície do líquido, fazendo com que o mesmo evapore).
Curva de Sublimação
Sólido ou vapor que se encontra abaixo da pressão do ponto triplo, se aquecido ou resfriado respectivamente, passa diretamente de uma fase para outra.
Processos gerais de separação de misturas
Mistura é a reunião de duas ou mais substâncias que não reagem entre si. As misturas são classificadas em Heterogêneas (apresentam mais de uma fase) e Homogêneas (apresentam uma única fase).
Em geral as misturas não tem propriedades físicas próprias, em lugar disso, as propriedades das misturas são propriedades das substâncias que a compõem.
Para se desdobrar uma mistura em seus componentes, é necessário que se tenha um conhecimento prévio dos mesmos, para que se possa utilizar o processo mais adequado, já que os processos dependem das propriedades físicas das substâncias que formam a mistura.
Em uma separação, podemos usar os seguintes processos:
* Para Misturas Heterogêneas
* Para Misturas Homogêneas
Comentaremos, resumidamente, quatro dos principais processos acima citados:
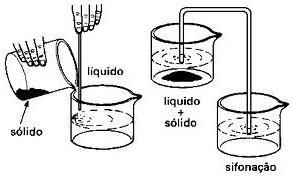
Decantação e Sifonação: Baseia-se nas propriedades físicas de sólido-líquido (para decantação e sifonação) e líquido-líquido (para o funil de decantação), mas nem sempre é um dos métodos mais eficientes, porque na maioria das vezes não se consegue obter uma separação completa das substâncias ao utilizar o método de sifonação (se for sólido-líquido), porque durante o mesmo pode ocorrer de vir algumas partículas sólidas junto com o líquido. Uma maior eficiência deste processo é observada quando utilizado em mistura de líquido-líquido, usando para isto o funil de decantação.
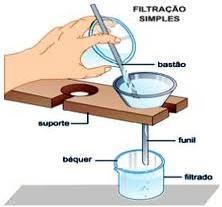
Filtração Simples e à Pressão Reduzida (Vácuo): Neste processo podemos separar misturas heterogêneas de sólido-líquido. O líquido que passa pelo filtro é denominado como filtrado ou resultante e o sólido que fica retido no filtro é denominado como resíduo. A maior finalidade da filtração à pressão reduzida (vácuo) é acelerar o processo de filtração de uma solução pela diminuição da pressão.
Decantação (Funil): Neste processo deve ser usado apenas misturas heterogêneas de líquido-líquido, pois, este processo se baseia em diferenças de densidade e solubilidade. Durante o escoamento do líquido do funil de decantação a torneira deve ser controlada com a mão esquerda para que se possa controlar o fluxo do escoamento com maior facilidade e, é válido lembrar também que a solução deve ser escoada até a interface que separa o líquido mais denso do menos denso, chegue próximo a torneira.
Destilação Simples e à Pressão Reduzida (Vácuo): Nos dois tipos de destilações (pressão normal e reduzida) podem ser separadas misturas homogêneas de sólido-líquido. Deve-se montar o esquema de aparelhagem de destilação (em laboratório) com muito cuidado, observando-se que a entrada de água deve ser feita pela parte inferior do condensador para que ela circule ocupando todo o espaço, porque se ocorrer um erro na montagem e a entrada de água for colocada na parte superior, ela "descerá" pelo condensador sem circular e completar o volume do mesmo, logo, será impossível haver a condensação pelo resfriamento dos gases.
Destilação Simples
SEPARAÇÃO DE MISTURAS HOMOGÊNEAS
Destilação simples
(sólido + líquido)
Por aquecimento, só o líquido entra em ebulição, vaporiza-se e a seguir condensa-se, separando-se do sólido. Ex.: destilar solução de permanganato de potássio.
Por aquecimento, só o líquido entra em ebulição, vaporiza-se e a seguir condensa-se, separando-se do sólido. Ex.: destilar solução de permanganato de potássio.
Destilação fracionada
(líquido + líquido)
É utilizada quando temos líquidos que tenham diferentes pontos de ebulição (P.E.) que passam através de uma coluna de fracionamento. Por aquecimento, os líquidos vaporizam-se e a seguir condensam-se, separadamente, à medida que vão sendo atingidos os seus P.E. Ex.: fracionamento do petróleo
É utilizada quando temos líquidos que tenham diferentes pontos de ebulição (P.E.) que passam através de uma coluna de fracionamento. Por aquecimento, os líquidos vaporizam-se e a seguir condensam-se, separadamente, à medida que vão sendo atingidos os seus P.E. Ex.: fracionamento do petróleo
Liquefação fracionada
(gás + gás)
Por resfriamento da mistura, os gases se liquefazem separadamente, à medida que vão sendo atingidos os seus P.E. Ex.: mistura de O2 e N2
Por resfriamento da mistura, os gases se liquefazem separadamente, à medida que vão sendo atingidos os seus P.E. Ex.: mistura de O2 e N2
Aquecimento simples
(gás + líquido)
Por aquecimento abaixo do PE do líquido, o gás dissolvido é expulso. Ex.: água com CO2
Por aquecimento abaixo do PE do líquido, o gás dissolvido é expulso. Ex.: água com CO2
Evaporação - o componente líquido é separado do sólido após se deixar evaporar o líquido presente. Ex.: separar o sal da água do mar.
SEPARAÇÃO DE MISTURAS HETEROGÊNEAS
Todas as fases são sólidas
Catação - Os fragmentos são catados com a mão ou pinça. Ex.: separar arroz do feijão.
Ventilação - Separação do componente mais leve por corrente de ar. Ex.: separar a casca do arroz.
Levigação - Separação do componente mais leve por corrente de água que arrasta o componente menos denso. Ex.: separação de minérios.
Flotação - Separação por um líquido de densidade intermediária entre dois sólidos de densidades diferentes. O sólido menos denso flutua no líquido. Ex.: separação do ouro do seu minério com o auxílio de mercúrio líquido.
Dissolução fracionada - Separação por meio de um líquido que dissolve apenas um componente e não dissolve os outros. Necessita de um método auxiliar para retirar o líquido adicionado, geralmente filtração e evaporação. Ex.: mistura de areia e sal.
Separação magnética - Apenas um componente é atraído pelo ímã, geralmente ferro, níquel e cobalto. Ex.: areia com limalha de ferro
Fusão fracionada - Separação por aquecimento da mistura até a fusão do componente de menor P.F.
Cristalização fracionada - Adiciona-se um líquido que dissolva todos os sólidos. Por evaporação da solução obtida, os componentes cristalizam-se separadamente.
Peneiração ou tamização - separa-se grãos menores de maiores com o auxílio de uma peneira (conhecido também como tamis). O grãos maiores ficam retidos na peneira e os menores passam pela malha. Ex.: separar areia de pedregulhos.
Pelo menos uma das fases não é sólida
Sedimentação - Separação de duas ou mais camadas devido a diferentes densidades, sendo que a fase mais densa se deposita no fundo do recipiente em que se encontra.
Decantação - Após a sedimentação a fase líquida é escoada ou retirada por intermédio de um sifão.
Sifonamento - necessita que se estabeleça um diferença de altura entre o frasco que contém a mistura e a ponta do sifão para que haja escoamento da fase superficial da mistura.
Filtração - Separa a fase líquida ou gasosa da sólida por meio de uma superfície porosa que retém o sólido.Usam-se papel filtro ou filtro de porcelana. Ex.: coar o café, filtrar a água, aspirar o pó com aspirador.
Funil de decantação - separa dois líquidos imiscíveis (não se misturam entre si) com o auxílio de um funil de decantação (chamado também de pêra de decantação). Ao se abrir a torneira o líquido mais denso escoa separando-se do outro líquido. Ex.: água e azeite
Centrifugação - Decantação acelerada por um centrífuga. É utilizado quando as partículas sólidas são muito pequenas, o que demoraria para decantar. A centrífuga origina uma força que desloca as partículas para o fundo dos tubos do aparelho.
Câmara de poeira - passar um mistura sólido-gás no interior de uma câmara subdividida em tabiques (chicanas) onde a poeira fica retida o gás sai purificado. Ex.: ar com poeira.
Sublimação - é possível separar sólidos que sublimam a temperatura ambiente ou com leve aquecimento. Ex.: separar iodo de outros sólidos
Importante: não esquecer que na mistura não há reação química, por isso, podemos separar o sistema por um processo físico.

Densidade
É a relação entre massa (em gramas) de uma amostra de matéria e o volume (geralmente em cm3) ocupado por esta amostra.

Quando dizemos que um material é mais denso que o outro, significa que, comparando-se volumes iguais de ambos, o mais denso é o que possui maior massa.

ATIVIDADES:
01. Considere as afirmativas:
I. Como os CFC (clorofluorocarbonos) destroem a camada de ozônio que protege a Terra dos raios ultravioletas, eles estão sendo substituídos por outros gases, como o butano, por exemplo. O que diferencia os gases CFC do gás butano neste aspecto é uma propriedade química.
II. Matéria e energia são interconversíveis.
III. Três frascos de vidro transparente, fechados e exatamente iguais, contêm cada um a mesma massa de diferentes líquidos. Um contém água (d=1,00g/mL), o outro, clorofórmio (d=1,4g/mL) e o terceiro, álcool etílico (d=0,8g/mL). O frasco que contém menor volume de líquido é o do álcool etílico.
IV. São propriedades gerais da matéria: massa, extensão, compressibilidade, elasticidade e acidez.
V. A medida da massa de um corpo não varia em função da sua posição geográfica na Terra.
Das afirmativas acima são verdadeiras somente:
a) I, II, III e IV
b) I, II, III e V
c) II, III e V
d) I, II e V
02. O diagrama de fases de certa substância é representado abaixo

Marque V ou F para cada afirmativa abaixo:
( ) No ponto Q é possível encontrar a substância nos três estados físicos.
( ) Na região III a substância se encontra na fase sólida.
( ) Variando a pressão e/ou a temperatura, a substância pode passar da fase sólida diretamente para a gasosa.
( ) Ocorre a sublimação quando a substância passa de uma região para outra delimitada pela linha MQ.
( ) Para a substância em análise o aumento de pressão favorece a fusão e a substância diminui de volume ao se fundir.
03. Com relação ao número de fases, os sistemas podem ser classificados como homogêneos ou heterogêneos. Todas as alternativas correlacionam adequadamente o sistema e sua classificação, exceto:
- Água de coco/ heterogêneo
- Água do mar filtrada/ homogêneo;
- Laranjada/ heterogêneo
- Leite/homogêneo
04. Associe as atividades do cotidiano abaixo com as técnicas de laboratório apresentadas a seguir:
• Preparar cafezinho com café solúvel
• Preparar chá de saquinho
• Coar um suco de laranja
• Preparar chá de saquinho
• Coar um suco de laranja
1. Filtração 3. Extração
2. Solubilização 4. Destilação
2. Solubilização 4. Destilação
A seqüência correta é:
a) 2, 3 e 1.
b) 4, 2 e 3.
c) 3, 4 e 1.
d) 1, 3 e 2.
e) 2, 2 e 4.
b) 4, 2 e 3.
c) 3, 4 e 1.
d) 1, 3 e 2.
e) 2, 2 e 4.
Nenhum comentário:
Postar um comentário