Biologia:
Moléculas e substâncias químicas fundamentais aos seres vivos:
A matéria que forma os seres vivos
A matéria que constituí os seres vivos é chamadamatéria viva. Os elementos químicos que se encontram na matéria viva são denominadosbioelementos, e as moléculas que formam a matéria viva recebem o nome de bióméléculas.
Os bioelementos
Nos seres vivos há cerca de vinte elementos químicos entre os mais de cem que hoje conhecemos. Os mais abundantes são: oxigênio (O), hidrogênio (H), carbono (C), nitrogênio (N), cálcio (Ca), fósforo (P), enxofre (S), magnésio (Mg), cloro (Cl), potássio (K) e sódio (Na), sendo os quatro primeiros majoritários na matéria viva.
A vida está baseada no átomo de carbono. O carbono tem a propriedade de poder se combinar de maneira muito estável com outros átomos para formar uma grande variedade de moléculas, algumas delas bastante complexas (como as proteínas).
As biomoléculas
As biomoléculas podem ser inorgânicas ou orgânicas. A água e os sais minerais são biomoléculas inorgânicas.
As biomoléculas orgânicas são os glicídios (açúcares), os lipídios (gorduras), as proteínas e os ácidos
nucleicos (DNA e RNA).
nucleicos (DNA e RNA).
As biomoléculas inorgânicas são comuns a toda a matéria, tanto viva como inerte, ao passo que as orgânicas são mais abundantes na matéria viva. Nas biomoléculas orgânicas, é muito freqüente a polimerização, isto é, o fato de determinadas moléculas se unirem entre si, formando uma macromolécula. As unidades são chamadas monômeros e a molécula resultante, polímero. As macromoléculas biológicas são realmente grandes se comparadas às moléculas inorgânicas.
Os orgânulos celulares são estruturas supramoleculares, ou seja, formadas pela associação de diferentes macromoléculas.
ATIVIDADES:
Exercício 1:
Considere as seguintes características atribuídas aos seres vivos:
I. Os seres vivos são constituídos por uma ou mais células.
II. Os seres vivos têm material genético interpretado por um código universal.
III. Quando considerados como populações, os seres vivos se modificam ao longo do tempo.
Admitindo que possuir todas essas características seja requisito obrigatório para ser classificado como “ser vivo”, é correto afirmar que:
A) os vírus e as bactérias são seres vivos, porque ambos preenchem os requisitos I, II e III.
B) os vírus e as bactérias não são seres vivos, porque ambos não preenchem o requisito I.
C) os vírus não são seres vivos, porque preenchem os requisitos II e III, mas não o requisito I
D) os vírus não são seres vivos, porque preenchem o requisito III, mas não os requisitos I e II
E) os vírus não são seres vivos, porque não preenchem os requisitos I, II e III.
Exercício 2:
Considerando que todos os seres vivos necessitam de uma fonte de carbono para construir suas moléculas orgânicas, a diferença essencial entre os autotróficos e heterotróficos, respectivamente, é:
A) usar carbono orgânico e carbono inorgânico.
B) usar carbono inorgânico e carbono orgânico.
C) usar carbono da água e do ar.
D) usar metano e gás carbônico.
E) realizar respiração aeróbia e fermentação.
Exercício 3:
Analise as afirmações abaixo referentes aos seres vivos.
I. Relacionam-se e modificam o meio.
II. Reproduzem-se sexualmente.
III. Respondem aos estímulos do meio.
IV. Usam gás carbônico na produção de matéria orgânica.
São características comuns a todos os seres vivos:
A) I e II, apenas.
B) I, II e III, apenas.
C) I e III, apenas.
D) II e IV, apenas.
E) I, II, III e IV.
Física:
Historia da física.
INTRODUÇÃO
O estudo da física está relacionado à várias situações da nossa vida. Desde a Grécia Antiga o homem procura entender o funcionamento das coisas e buscou na ciência estas explicações. Hoje em dia, a física moderna atua em vários ramos da indústria, de tecnologia, de geração de energia entre outros.
Está importante ciência está dividida em várias áreas : mecânica, termologia, óptica, ondas, eletricidade, eletrodinâmica, cinemática e física nuclear.
A Física atua em parceria com outras áreas da ciência como, por exemplo, a matemática e a química. Muitos fenômenos físicos só podem ser explicados através de fórmulas matemáticas ou de reações químicas.
A Física atua em parceria com outras áreas da ciência como, por exemplo, a matemática e a química. Muitos fenômenos físicos só podem ser explicados através de fórmulas matemáticas ou de reações químicas.
HISTÓRICO RESUMIDO DA EVOLUÇÃO DA FÍSICA (1)
480 a.C. - O grego Leucipo chega a conclusão de que a matéria de todos os corpos é composta por partículas microscópicas chamadas de átomos.
260 a.C. - O grego Arquimedes descobre que os corpos flutuam, pois deslocam um pouco de líquido para os lados.
1269 - O francês Pèlerin de Maricourt descobre o funcionamento dos dois pólos magnéticos de um imã.
1589 - O Galileu Galilei, cientista italiano, chega a conclusão de que todos os corpos caem numa mesma velocidade independente de seu peso. É o princípio da física moderna e da lei de queda livre dos corpos.
1648 - Blaise Pascal faz importantes pesquisas sobre a pressão gerada pelo peso dos gases e da água.
1666 - O pesquisador inglês Isaac Newton chega a conclusão que a luz é formada pela junção de várias cores.
1678 - O físico holandês Christiaan Huygens é o primeiro a defender a idéia de que a luz se propaga como se fosse uma onda.
1687 - O físico Isaac Newton publica Princípios Matemáticos da Filosofia Natural. Neste livro, Newton define as principais leis da mecânica e demonstra que os corpos se atraem pela força de gravidade.
1752 - O pesquisador norte-americano Benjamim Franklin divulga suas pesquisas sobre raios, demonstrando que existem dois tipos de cargas elétricas, a negativa e a positiva.
1800 - O astrônomo inglês William Herschel faz uma importante descoberta sobre o Sol. O astro emite raios infravermelhos.
1822 - O matemático francês Jean-Baptiste Fourier desenvolve várias fórmulas sobre o fluxo de calor.
1847 - O físico Joule desenvolve a Primeira Lei da Termodinâmica, comprovando que a energia não pode ser criada, nem destruída.
1859 - O físico inglês James Clerk Maxwell desenvolve a Teoria Cinética dos Gases, demonstra como calcular a velocidade dos átomos de um gás.
1865 - O pesquisador inglês James Clerk Maxwell descobre a força eletromagnética, estudando a ação da energia elétrica e da magnética.
1888 - O cientista alemão Heinrich Hertz produz em laboratório as primeiras ondas de rádio.
1895 - Pesquisas do cientista alemão Wilheim Konrad Röntgen mostra a existência dos raios X.
1900 - O cientista alemão Max Planck faz pesquisas importantes na campo da Física Quântica. Estes estudos serviram de base para o desenvolvimento da Teoria da Relatividade.
1905 - O cientista alemão Albert Einstein cria a Teoria da Relatividade, onde conclui que o tempo não é absoluto.
1911 - O físico australiano Ernest Rutherford observa que quase toda a massa de um átomo se concentra em seu núcleo que é muito duro.
1932 - O físico inglês James Chadwick descobre a existência o nêutron, uma das partículas que forma o núcleo do átomo junto com o próton.
1939 - Os físico-químicos alemães Otto Hahn e Lise Meitner realizam experiência onde conseguem fazer a fissão do núcleo do urânio, partindo seu núcleo.
1975 - O inglês Stephen Hawking conclui que um buraco negro pode evaporar, perdendo uma pequena quantidade de massa.
1999 - A física dinamarquesa Lene Vestergaard, consegue reduzir a velocidade da luz, fazendo com que esta ultrapasse uma matéria conhecida como condensado de Bose-Einsten. A velocidade da luz é reduzida em 18 milhões de vezes.
2000 - Cientistas do Centro Europeu de Pesquisas Nucleares comprovam que é possível tirar partículas subatômicas, os quarks, dos prótons e nêutrons.
PRINCIPAIS ÁREAS DA FÍSICA
- Mecânica
- Termologia
- Ondulatória
- Acústica
- Óptica
- Eletromagnetismo
- Física de Particulas
- Teoria da Relatividade
- Física Atômica
- Física Molecular
- Física Nuclear
- Mecânica Quântica
- Física de Plasmas
- Astrofísica
- Física de Materiais
Sistema Internacional de Unidades (SI)
O Sistema Internacional de Unidades, ou, abreviadamente, SI, é um conjunto de unidades métricas oficiais para cada grandeza física. Tal sistema foi estabelecido em 1960 na Conferência Geral de Pesos e Medidas, realizada em Paris.
De acordo com o SI, existem 2 tipos de unidades de medida: as fundamentais ou de base e asderivadas. Por convenção, as unidades fundamentais são aquelas independentes, que servem de referência para a determinação de novas medidas. Veja uma breve explicação sobre cada um das 7 unidade fundamental do SI.
No sistema de medidas oficial, o tempo deve ser expresso em segundos, cujo símbolo é s. No nosso dia a dia utilizamos com mais frequência outras unidades de tempo, como horas, minutos, dias, semanas, meses, anos, séculos, etc., porém, elas não pertencem ao SI e, assim, devem ser convertidas em segundos nas equações da Física. Observe na tabela abaixo as conversões de algumas destas unidades para segundos.
Em termos de massa, a unidade de medida oficial é o quilograma, representado pelo símbolo kg. Essa unidade foi definida como a massa de um cilindro padrão, que, por convenção, corresponde a 1 kg. Sendo assim, a massa de um corpo qualquer pode ser determinada através da comparação de sua massa com a do cilindro.
É evidente que esta unidade não será um parâmetro para medir as massas de corpos muito pequenos, como um átomo, nem de corpo muito grandes, como um planeta. Por isso, existem outras de medida que são comumente utilizadas, mas que não fazem parte do SI, como é o caso da grama (g) e da tonelada (t).
A unidade de comprimento do SI é o metro, simbolizado pela letra m. Através de estudos físicos, o metro foi definido como o comprimento da trajetória percorrida pela luz durante o intervalo de 1/299792458 de segundo.
No Sistema Inglês, adotado por Estados Unidos e Inglaterra, são utilizadas outras unidades de comprimentos:
O ampère, representado pela letra A, é a unidade de medida de corrente elétrica, que, por definição, equivale à força exercida por dois paralelos que carregam a corrente. O nome da unidade é uma homenagem ao físico francês André-Marie Ampère.
No SI, a unidade de medida da temperatura é o kelvin (k), que corresponde a 1/273,15 da temperatura absoluta do ponto triplo da água. O zero kelvin é definido como o zero absoluto, ou seja, é a temperatura na qual toda a agitação de partículas cessaria, por isso, a escala Kelvin é considerada como escala absoluta.
As escalas Celsius e Fahrenheit também são muito utilizadas, no entanto, são chamadas de escalas relativas e não pertencem ao SI.
De acordo com o SI, o mol é a unidade oficial que mede a quantidade de matéria. O mol é definido como a quantidade de substância que contém 6,02 x 1023 entidades elementares, logo, 1 mol de átomos tem 6,02 x 1023, assim como um mol de moléculas também possui 6,02 x 1023 moléculas, por exemplo.
A candela, cujo símbolo é cd, é a unidade de medida da intensidade luminosa. Define-se candela como a intensidade da luz numa determinada direção que emite uma radiação de frequência 540x1012 Hz.
Como o próprio nome já sugere, as unidades derivadas são aquelas que se originam do produto das unidades fundamentais. As unidades derivadas, ao contrário das fundamentais, não tem um número limitado, por isso, listamos alguns exemplos dessas grandezas na tabela a seguir.
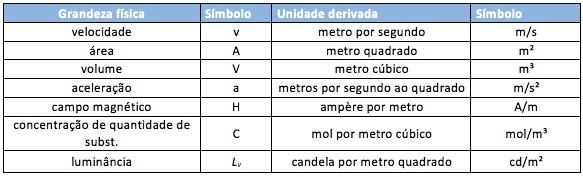
De acordo com o SI, existem 2 tipos de unidades de medida: as fundamentais ou de base e asderivadas. Por convenção, as unidades fundamentais são aquelas independentes, que servem de referência para a determinação de novas medidas. Veja uma breve explicação sobre cada um das 7 unidade fundamental do SI.
Unidade de tempo
No sistema de medidas oficial, o tempo deve ser expresso em segundos, cujo símbolo é s. No nosso dia a dia utilizamos com mais frequência outras unidades de tempo, como horas, minutos, dias, semanas, meses, anos, séculos, etc., porém, elas não pertencem ao SI e, assim, devem ser convertidas em segundos nas equações da Física. Observe na tabela abaixo as conversões de algumas destas unidades para segundos.
Nome
|
Símbolo
|
Equivalente em segundos
|
minuto
|
min
|
1 m = 60 s
|
hora
|
h
|
1 h = 60 min = 3600 s
|
Unidade de massa
Em termos de massa, a unidade de medida oficial é o quilograma, representado pelo símbolo kg. Essa unidade foi definida como a massa de um cilindro padrão, que, por convenção, corresponde a 1 kg. Sendo assim, a massa de um corpo qualquer pode ser determinada através da comparação de sua massa com a do cilindro.É evidente que esta unidade não será um parâmetro para medir as massas de corpos muito pequenos, como um átomo, nem de corpo muito grandes, como um planeta. Por isso, existem outras de medida que são comumente utilizadas, mas que não fazem parte do SI, como é o caso da grama (g) e da tonelada (t).
Unidade de comprimento
A unidade de comprimento do SI é o metro, simbolizado pela letra m. Através de estudos físicos, o metro foi definido como o comprimento da trajetória percorrida pela luz durante o intervalo de 1/299792458 de segundo.No Sistema Inglês, adotado por Estados Unidos e Inglaterra, são utilizadas outras unidades de comprimentos:
Nome
|
Símbolo
|
Equivalente em unidades SI
|
polegada
|
in.
|
2,4 cm = 0,0254 m
|
pé
|
ft
|
30,48 cm = 0,3048 m
|
jarda
|
yd
|
91,44 cm = 09144 m
|
milha
|
mi
|
~ 1690 m
|
Unidade de corrente elétrica
O ampère, representado pela letra A, é a unidade de medida de corrente elétrica, que, por definição, equivale à força exercida por dois paralelos que carregam a corrente. O nome da unidade é uma homenagem ao físico francês André-Marie Ampère.
Unidade de temperatura
No SI, a unidade de medida da temperatura é o kelvin (k), que corresponde a 1/273,15 da temperatura absoluta do ponto triplo da água. O zero kelvin é definido como o zero absoluto, ou seja, é a temperatura na qual toda a agitação de partículas cessaria, por isso, a escala Kelvin é considerada como escala absoluta.As escalas Celsius e Fahrenheit também são muito utilizadas, no entanto, são chamadas de escalas relativas e não pertencem ao SI.
Unidade de quantidade de matéria
De acordo com o SI, o mol é a unidade oficial que mede a quantidade de matéria. O mol é definido como a quantidade de substância que contém 6,02 x 1023 entidades elementares, logo, 1 mol de átomos tem 6,02 x 1023, assim como um mol de moléculas também possui 6,02 x 1023 moléculas, por exemplo.
Unidade de intensidade luminosa
A candela, cujo símbolo é cd, é a unidade de medida da intensidade luminosa. Define-se candela como a intensidade da luz numa determinada direção que emite uma radiação de frequência 540x1012 Hz.
Unidades derivadas
Como o próprio nome já sugere, as unidades derivadas são aquelas que se originam do produto das unidades fundamentais. As unidades derivadas, ao contrário das fundamentais, não tem um número limitado, por isso, listamos alguns exemplos dessas grandezas na tabela a seguir.
ATIVIDADES:
01. (...) Depois de longas investigações, convenci-me por fim de
que o Sol é uma estrela fixa rodeada de planetas que giram em volta
dela e de que ela é o centro e a chama. Que, além dos planetas
principais, há outros de segunda ordem que circulam primeiro como
satélites em redor dos planetas principais e com estes em redor do
Sol. (...) Não duvido de que os matemáticos sejam da minha opinião,
se quiserem dar-se ao trabalho de tomar conhecimento, não
superficialmente mas duma maneira aprofundada, das demonstrações
que darei nesta obra. Se alguns homens ligeiros e ignorantes quiserem
cometer contra mim o abuso de invocar alguns passos da Escritura
(sagrada), a que torçam o sentido, desprezarei os seus ataques: as
verdades matemáticas não devem ser julgadas senão por matemáticos.
(COPÉRNICO, N. De Revolutionibus caelestium.)
Aqueles
que se entregam à prática sem ciência são como o navegador que
embarca em um navio sem leme nem bússola. Sempre a prática deve
fundamentar-se em boa teoria. Antes de fazer de um caso uma regra
geral, experimente-o duas ou três vezes e verifique se as
experiências produzem os mesmos efeitos. Nenhuma investigação
humana pode se considerar verdadeira ciência se não passa por
demonstrações matemáticas. (VINCI, Leonardo da. Camets.)
O
aspecto a ser ressaltado em ambos os textos para exemplificar o
racionalismo moderno é:
a)
A fé como guia das descobertas.
b)
O senso crítico para se chegar a Deus.
c)
A limitação da ciência pelos princípios bíblicos.
d)
A importância da experiência e da observação.
e)
O princípio da autoridade e da tradição.
02. Analise as sentenças a seguir.
I
. O século XVI foi marcado pela revolução científica no estudo da
Física. No início deste século, o polonês Nicolau Copérnico
postulou o heliocentrismo do Sistema Solar, em oposição às ideias
geocêntricas de Aristóteles e Ptolomeu.
II
. Os trabalhos de Copérnico, Kepler e Galileu, no século XVI, foram
fundamentais para que no século seguinte Newton equacionasse a
gravitação universal e o movimento dos corpos celestes, bem como as
leis dos movimentos dos corpos terrestres.
III.
Os trabalhos de Einstein, publicados a partir de 1905, vieram
comprovar definitivamente todas as ideias newtonianas.
Está(ão)
correta(s):
a.
Apenas a sentença I.
b.
Apenas a sentença II.
c.
Apenas a sentença II.
d.
Apenas as sentenças I e II.
e.
Apenas as sentenças II e III
03. A atleta brasileira Fabiana Murer alcançou a marca de 4,60 m no
salto com vara, nos Jogos Pan-americanos realizados no Rio de Janeiro
em 2007. Sua melhor marca é de 4,80 m, recorde sul-americano na
categoria. Qual é a diferença, em centímetro, entre essas duas
marcas?
a)
20. b)
0,2 c)
2. d)
200. e)
N.d.a.
04. Raquel saiu de casa às 13h 45min, caminhando até o curso de
inglês que fica a 15 minutos de sua casa, e chegou na hora da aula
cuja duração é de uma hora e meia. A que horas terminará a aula
de inglês?
a)
14h b) 14h 30min c) 15h 15min d) 15h
30min e) 15h 45min
05 Uma torneira do tanque de uma residência que está pingando, vaza
300 ml por dia. Considerando um mês de 30 dias, é correto afirmar
que, se esta torneira não for consertada, a quantidade total de água
desperdiçada ao final desse mês será, em litros, igual a
a)
0,09 b)
0,9 c)
9 d)
0,3 e)
3
06. Um quarteirão tem uma área de 1 km². O Sr. João comprou um
terreno de 1000 m² dentro desse quarteirão. Logo, a área do
terreno que o Sr. João comprou corresponde à área do quarteirão
em
a)
0,1. b)
0,01. c)
0,001. d)
0,0001. e)
0,00001.
Química:
c
Transformações físicas e químicas:
Distinguir transformações físicas e químicas | ||||||
Transformações físicas
As transformações físicas são aquelas que ocorrem sem que se formem novas
substâncias. Os seja, as substâncias continuam a ser as mesmas, poderão apenas
estar mais divididas, por exemplo, ou mudarem de estado físico.
Exemplos de transformações físicas:
Transformações químicas
As transformações químicas ocorrem, quando existe a formação de novas
substâncias, isto é, substâncias com propriedades diferentes das substâncias iniciais.
São exemplos de transformações químicas, muitas das situações que te rodeiam
no dia-a-dia, tais como:
| ||||||
No decurso das transformações químicas ou reações químicas em que se
formam as novas substâncias, existem algumas evidências facilmente observáveis
que permitem verificar a ocorrência dessas transformações. Por exemplo:
| ||||||
TRANSFORMAÇÕES QUÍMICAS
Numa transformação química, as substâncias iniciais chamam-se reagentes
e as novas substâncias que se formam chamam-se produtos de reação.
As transformações químicas podem ocorrer por:
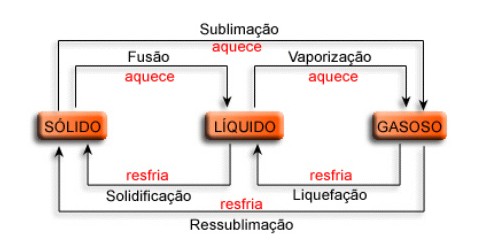
Mudanças de Estado Físico da Matéria.
O que caracteriza e define um estado físico da matéria são as forças atuantes em seu interior; coesão,
a qual tende a aproximar as partículas, e repulsão, a qual tende a afastá-las. Quando a força de coesão
supera a de repulsão, a substância se apresentará na fase de agregação chamada de sólido, quando as
forças apresentarem a mesma intensidade, teremos um líquido, quando a de repulsão superar a de
coesão, teremos então um gás. Cada um desses estados físicos distingue-se dos outros, entre outros
fatores, por sua forma e volume. O estado sólido apresenta forma e volume constante, o líquido forma
variável e volume constante, e o gasoso, forma e volume variáveis.
a) FUSÃO
b) VAPORIZAÇÃO: representa a passagem do estado líquido para o estado gasoso. A temperatura na
qual ocorre recebe o nome de Ponto de Ebulição. Uma vaporização pode ocorrer de três modos distintos:
Por exemplo, gotas de água sendo derramadas em uma chapa metálica aquecida.
- EBULIÇÃO: passagem do estado líquido para o estado gasoso por meio de aquecimento direto, envolvendo
todo o líquido. Por exemplo, o aquecimento da água em uma panela ao fogão.
- EVAPORAÇÃO: passagem do estado líquido para o estado gasoso que envolve apenas a superfície do líquido.
Por exemplo, a secagem de roupas em um varal.
c) LIQUEFAÇÃO ou CONDENSAÇÃO: representa a passagem do estado gasoso para o estado líquido.
Por exemplo, a umidade externa de um frasco metálico ao ser exposto a uma temperatura relativamente
elevada.
d) SOLIDIFICAÇÃO: representa a passagem do estado líquido para o estado sólido. Por exemplo, o
congelamento da água em uma forma de gelo levada ao refrigerador.
e) SUBLIMAÇÃO: representa a passagem do estado sólido para o estado gasoso ou o processo inverso,
sem passagem pelo estado líquido. Por exemplo, a sublimação do gás carbônico
| ||||||
Propriedades da Matéria
Todas as substâncias possuem várias características ou propriedades diferentes. Por exemplo, duas das propriedades da gasolina são: ser líquida à temperatura ambiente e entrar em combustão sob determinadas condições. Essas duas propriedades são muito diferentes entre si, pois o fato de a água estar líquida, sólida ou gasosa não interfere na sua composição. Já quando ela queima, ocorre uma transformação na sua constituição e são produzidos outros materiais e energia.
A partir desse exemplo, conseguimos perceber que as propriedades das substâncias podem ser classificadas em grupos diferentes. A seguir veremos quatro desses grupos:
• Propriedades Gerais: são aquelas propriedades que não identificam uma substância como diferente das demais, pois ela pode se repetir com outros materiais. Por exemplo, a massa e o volume são propriedades usadas para medir diversos materiais, principalmente para comercializá-los. Portanto, a massa e o volume são propriedades gerais.
• Propriedades Específicas: são aquelas que não se repetem para mais de uma substância e que podem servir, portanto, para identificá-las. Por exemplo, a temperatura de fusão e de ebulição da água pura, ao nível do mar, é sempre 0°C e 100°C, respectivamente. Veja abaixo os pontos de fusão (PF) e de ebulição (PE) que diferenciam algumas substâncias à pressão de 1 atm:

Além dessas citadas, outras propriedades físicas específicas da matéria são: densidade; condutividade térmica e elétrica; e propriedades organolépticas, que são aquelas relacionadas aos sentidos, como cor, cheiro, textura e sabor. As propriedades organolépticas não são confiáveis, pois além de algumas vezes nos enganarmos ou discordarmos quanto à cor, por exemplo, é também muito perigoso para a saúde cheirar, tocar e ingerir substâncias desconhecidas.
• Propriedades Intensivas: essas propriedades não dependem da quantidade de material contida na amostra. Por exemplo, a densidade do gelo não muda se o seu volume for maior. É por isso que um cubo de gelo e um iceberg flutuam na água, independentemente do seu tamanho. A temperatura também é uma propriedade intensiva.
• Propriedades Extensivas: são o contrário das propriedades intensivas, pois dependem da quantidade da amostra. Por exemplo, a energia liberada na combustão aumenta se aumentarmos os combustíveis. Outros exemplos de propriedades extensivas são: massa e volume.

ATIVIDADES:
01. A elevação da temperatura de um sistema produz, geralmente, alterações que podem ser interpretadas como sendo devidas a processos físicos ou químicos.
Medicamentos, em especial na forma de soluções, devem ser mantidos em recipientes fechados e protegidos do calor para que se evite:
I. a evaporação de um ou mais de seus componentes;
II. a decomposição e consequente diminuição da quantidade de composto que constitui o princípio ativo;
III. a formação de compostos indesejáveis ou potencialmente prejudiciais à saúde.
Cada um desses processos – I, II, III – corresponde a um tipo de transformação classificada, respectivamente, como:
a) física, física e química
b) física, química e química
c) química, física e física
d) química, física e química
e) química, química e física
02. Em quais das passagens a seguir está ocorrendo transformação química?
1) “ O reflexo da luz nas águas onduladas pelos ventos lembrava-lhe os cabelos de seu amado”.
2) “ A chama da vela confundia-se com o brilho nos seus olhos”.
3) “Desolado, observava o gelo derretendo em seu copo e ironicamente comparava-o ao seu coração.”
4) “Com o passar dos tempos começou a sentir-se como a velha tesoura enferrujando no fundo da gaveta.”
Estão corretas apenas:
a) 1 e 2
b) 2 e 3
c) 3 e 4
d) 2 e 4
e) 1 e 3
03. Considerando-se as transformações:
- A água líquida é obtida a partir do gelo ao se fornecer energia na forma de calor:

- As chuvas ácidas transformaram a superfície do mármore de estátuas gregas em gesso macio e sujeito à erosão:

- Uma poção de ferro interage com o oxigênio em presença da umidade, transformando-se em ferrugem:

É correto afirmar que os fenômenos ocorridos são identificados, respectivamente, como:
- Físico, químico, físico.
- Físico, químico, químico.
- Físico, físico, químico.
- Químico, químico, físico.
- Químico, físico, físico.
04. Para combater traças e baratas, era comum colocar algumas bolinhas de naftalina no guarda-roupa. Com o passar do tempo, essas bolinhas diminuíam de tamanho. Esse fenômeno é uma mudança de estado físico chamada de:
- Solidificação.
- Condensação.
- Fusão.
- Sublimação.
- Evaporação.
05. Observe:
I – Uma pedra de naftalina deixada no armário;
II – Uma vasilha de água deixada no freezer;
III- Uma vasilha de água deixada no fogo;
IV – O derretimento de um pedaço de chumbo quando aquecido;
Nesses fatos estão relacionados corretamente os seguintes fenômenos:
a) I. Sublimação; II. Solidificação; III. Evaporação; IV. Fusão.
b) I. Sublimação; II. Sublimação; III. Evaporação; IV. Solidificação.
c) I. Fusão; II. Sublimação; III. Evaporação; IV. Solidificação.
d) I. Evaporação; II. Solidificação; III. Fusão; IV. Sublimação.
e) I. Evaporação; II. Sublimação; III. Fusão; IV. Solidificação.
06. A formação de nuvens obedece ao ciclo da água na natureza, onde primeiro ocorre a evaporação e em seguida, a precipitação de gotículas de H2O. Imagine então o processo de formação das nuvens como sendo uma mudança de estado físico da água, qual dos itens abaixo melhor representa esta transformação:
a) dissolução
b) destilação
c) sublimação
d) decantação
e) filtração
Nenhum comentário:
Postar um comentário